海洋无脊椎动物血淋巴的吞噬调控机制取得新进展
中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室(LMB)海洋生物分子生物学和遗传学研究团队长期从事天然免疫的演化机制的研究,近期在海洋无脊椎动物牡蛎血淋巴的吞噬调控机制方面取得了重要研究进展,研究成果分别发表在国际期刊《Scientific Report》和《iScience》。毛帆助理研究员和硕士研究生张翔宇分别为第一作者,张扬和喻子牛研究员为共同通讯作者。
吞噬作用是生物最古老和基础的细胞防御机制之一,由细胞表面的模式识别、胞内吞噬体形成和成熟等一系列关键事件所组成。但目前在海洋无脊椎动物中其作用机制和调控机理尚未明晰。为了阐明牡蛎吞噬过程的分子机理,课题组研究人员通过密度梯度离心结合高通量蛋白定量技术,鉴定了牡蛎血淋巴细胞的早期和晚期吞噬体蛋白,揭示了细胞骨架重塑和Rab蛋白的信号调控驱动吞噬体形成和成熟,并证实了内质网参与了吞噬体的成熟。其中GTPase信号家族成员CgRhoGDI和CgPI4K通过控制细胞骨架重塑影响吞噬体的成熟和病原清除(图1)。本研究不仅揭示了牡蛎吞噬作用是一个高度复杂和动态调节得过程,还为深入了解无脊椎动物吞噬的演化提供了基础框架。论文于2020年4月20日,以“Hemocyte phagosomal proteome is dynamically shaped by cytoskeleton remodeling and interorganellar communication with endoplasmic reticulum during phagocytosis in a marine invertebrate, Crassostrea gigas”为题发表在《Scientific Report》上。
牡蛎的吞噬作用经过漫长地进化,对周围环境也展示出了独特的适应性。课题组研究人员发现,海水中丰度最高的阴离子-氯离子在牡蛎血淋巴免疫防御过程中发挥着关键作用。牡蛎血淋巴细胞在感染或吞噬过程中都可以显著地激活氯离子内流,同时,抑制氯离子通道可明显阻止血淋巴细胞的吞噬和杀菌能力。进一步研究发现,氯离子内流可以激活PI3K/Akt信号通路从而调控吞噬形成,并促进吞噬体的酸化和HOCl产生介导其杀菌能力。通过牡蛎基因组序列筛选,发现了CLIC2α是负责氯离子内流的关键基因,介导了氯离子依赖的免疫防御调控。论文于2020年6月29日,以“CLIC2a Chloride Channel Orchestrates Immunomodulation of Hemocyte Phagocytosis and Bactericidal Activity in Crassostrea gigas” 为题发表在《iScience》上。
上述研究对牡蛎吞噬的分子调控机制进行了比较系统的解析,增加了无脊椎动物免疫防御认知方面的新维度,为更深入的天然免疫分子演化研究奠定了良好基础。本项工作受国家自然科学基金、南方海洋科学与工程广东省实验室(广州)、国家贝类产业体系、广州市珠江科技新星、中国科学院南海生态环境工程创新研究院等项目共同资助。
相关论文链接:
1)https://www.nature.com/articles/s41598-020-63676-3
2)https://www.sciencedirect.com/science/article/pii/S2589004220305150?via%3Dihub
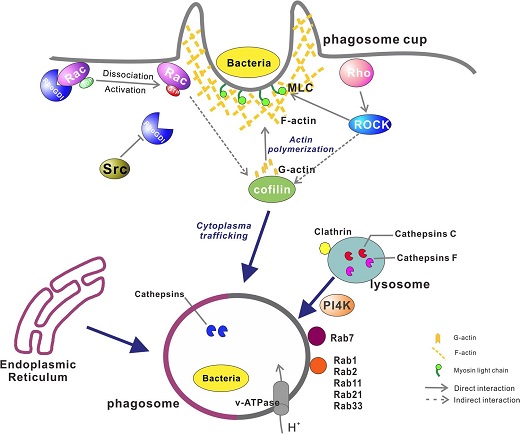
图1:牡蛎血淋巴细胞的吞噬作用的分子机制
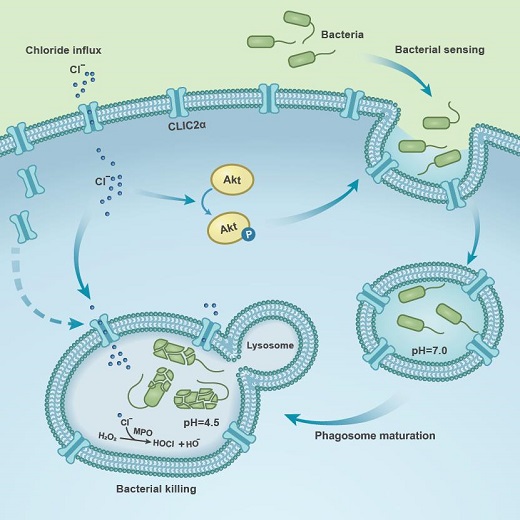
图2:氯离子的吞噬调控机制
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号