海洋无脊椎动物血淋巴分化和自噬取得新进展
LMB海洋生物分子生物学和遗传学研究团队近期在无脊椎动物牡蛎血淋巴的分化机制、吞噬细胞激活和自噬免疫方面取得了重要研究进展。血淋巴细胞是无脊椎动物最核心的免疫器官,解析其分化和吞噬细胞激活的调控机制是理解细胞免疫的关键。牡蛎血淋巴可分为颗粒细胞和透明细胞两类群,其中前者具有极强的吞噬能力和激发ROS的能力,是免疫防御的主要执行者。研究者利用流式细胞分选结合单细胞转录组测序,发现颗粒细胞中175个特异高表达的核心差异表达基因,表明其可能是一种“激活态”的细胞类群。进一步分析显示,这些基因形成了以Cdc42为核心的调控网络,调节了细胞骨架、吞噬作用、线粒体呼吸链等多种免疫细胞活动。同时,通过系统敲降颗粒细胞特异的转录因子,发现FOS调控多个特异基因的转录激活,提示了其在颗粒细胞形成分化过程中的关键作用(图1)。
为更好解析吞噬细胞激活的调控机制,研究者利用磁珠分选法分离了牡蛎的吞噬细胞;结合RNA-seq分析显示,粘附斑信号通路和细胞外基质(ECM)在吞噬细胞中显著激活,抑制粘附斑激酶信号显著地降低了细胞的吞噬效率。同时还发现大量ECM 分子特异地在吞噬细胞中分布,其中最显著的是硫酸肝素蛋白多糖(HSPGs)家族成员;内源性阻断HSPGs合成或干扰其修饰则降低吞噬细胞的吞噬能力,并改变其形态和聚集能力。进化分析显示HSPGs基因在基因组中出现了种系特异性扩张,表明HSPGs家族是吞噬细胞的关键表面受体,可识别病原并和启动吞噬(图2)。上述研究分别在2020年5月27日及2020年3月20日以“Transcriptomic Evidence Reveals the Molecular Basis for Functional Differentiation of Hemocytes in a Marine Invertebrate, C. gigas”和“Phagocyte Transcriptomic Analysis Reveals Focal Adhesion Kinase (FAK) and Heparan Sulfate Proteoglycans (HSPGs) as Major Regulators in Anti-bacterial Defense of C. hongkongensis”为题发表在《Frontiers in Immunology》。
自噬是真核细胞维持环境内稳态的重要调节机制,并在细胞免疫防御中发挥着重要的作用。研究者发现弧菌感染可诱导牡蛎血淋巴自噬的发生,抑制自噬可导致胞质空泡出现,引发细胞凋亡并降低杀菌能力。同时,弧菌感染会诱导氧化应激和能量胁迫的双重压力,包括超氧阴离子(O2-)和过氧化氢(H2O2)等活性氧自由基(ROS)的积累和磷酸腺苷(AMP)的产生。AMP和H2O2不仅能够单独引发自噬,还能以协同方式激活自噬关键的信号通路AMPK。最后,通过抑制AMPK磷酸化或清除ROS积累,都可以阻断感染诱导的自噬发生(图3)。本研究首次明确了自噬在牡蛎天然免疫的重要作用,并提出了ROS和AMP协同激活自噬的新机制。论文于2020年6月3日以“Autophagy Dually Induced by AMP Surplus and Oxidative Stress Enhances Hemocyte Survival and Bactericidal Capacity via AMPK Pathway in C. hongkongensis”为题发表在《Frontiers in Cell and Developmental Biology》。
上述三篇论文中毛帆助研、研究生林玥和党欣分别为第一作者,张扬和喻子牛研究员为共同通讯作者。上述研究受国家自然科学基金、南方海洋科学与工程广东省实验室(广州)、国家贝类产业体系、广州市珠江科技新星、中国科学院南海生态环境工程创新研究院等项目共同资助。
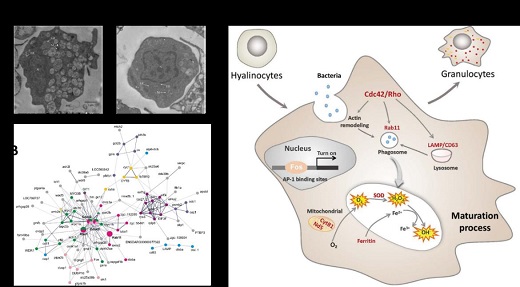
图1:血淋巴细胞分化的分子机制
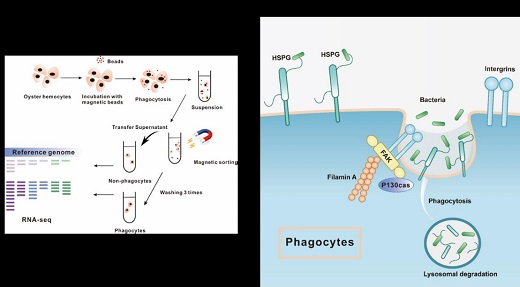
图2:牡蛎吞噬细胞的分子调控模型
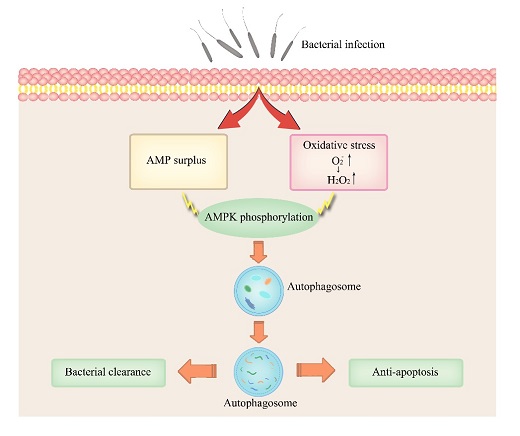
图3: AMP和ROS协同激活自噬发生
相关论文链接:
1)https://www.frontiersin.org/articles/10.3389/fimmu.2020.00911/full
2)https://www.frontiersin.org/articles/10.3389/fimmu.2020.00416/full
3)https://www.frontiersin.org/articles/10.3389/fcell.2020.00411/full
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号