《PNAS》揭示质粒上毒素/抗毒素系统的新功能
1月22日,中国科学院南海海洋研究所研究员王晓雪团队在《美国科学院院刊》(PNAS)在线发表了题为“接合型质粒编码的毒素/抗毒素系统PrpT/PrpA直接调控质粒拷贝数”(Conjugative Plasmid-Encoded Toxin-Antitoxin System PrpT/PrpA Directly Controls Plasmid Copy Number)的研究论文,系统阐述了质粒编码的毒素/抗毒素系统调控质粒复制功能的发现和作用机制。
质粒是存在于细菌染色体之外具有独立复制能力的遗传元件。接合型质粒除了编码复制、分配和接合转移系统以外,往往还携带毒力基因和抗性基因。接合型质粒介导的水平基因转移是细菌耐药性(包括碳青霉烯、多粘菌素等)快速扩散的重要途径。尤其关键的是,这些质粒能够在不存在抗生素的环境里依然稳定存在于细菌中,并进一步介导抗性基因的传播。因此,接合型质粒的稳定性机制是临床感染研究中关注的热点。
毒素/抗毒素系统(Toxin/Antitoxin System, TA)是最早发现具有稳定质粒功能的二元系统。TA系统在1983年发现存在于接合型质粒上,在功能上被认为通过“分离后致死效应“(Post-segregational killing, PSK)来维持质粒的稳定性。在PSK理论中,当质粒在细胞分裂过程中由于复制或分离错误发生丢失时,在不含质粒的子代细胞中,相对稳定的毒素蛋白会由于失去抗毒素的中和作用发挥出毒性抑制细胞的分裂或直接杀死细胞,从而达到在群体中维持质粒稳定存在的目的。ParDE系统是最早支持PSK理论的研究模型之一。
随着基因组测序技术的发展,大规模的临床和环境微生物基因组分析发现接合型质粒上富集大量TA系统。2000年坎特伯雷大学Heinemann研究团队在PNAS文章中提出了PSK理论的不足,认为质粒上TA系统的富集是质粒与质粒间竞争的结果,而并非是通过PSK机制来实现的。因为PSK理论很容易通过在模式细菌中异源表达TA来证实,因此一直被广泛用来作为解释质粒上富集TA系统的理论基础,但仅用异源表达的手段来研究TA的功能存在局限性,容易忽视TA系统的多样性生物学功能。
研究团队在前期的工作中,发现海洋细菌中携带一个接合型质粒,能够稳定存在并保持1个拷贝/细胞。接下来为了研究质粒的稳定机制,对质粒上编码基因进行了功能的研究。分析发现,这个质粒编码一对II型TA系统PrpT/PrpA,其中PrpT是ParE类家族毒素,而PrpA是功能未知的新颖抗毒素。意外的是,敲除prpA-prpT后,质粒的稳定性并没有受影响。反而,质粒的拷贝数出现了显著的异常升高。基因回补实验证实了这一点。在机制方面,发现是其中的抗毒素PrpA直接调控了质粒的拷贝数,并且PrpA直接结合质粒复制起始区上的重复子序列(iterons),以浓度依赖的方式竞争性的阻碍质粒复制蛋白RepB对复制起始区的结合,避免质粒的过度复制。
研究结果发现抗毒素蛋白与质粒的复制蛋白一起来维持质粒的低拷贝数,这与敲除TA后质粒出现高拷贝的表型是一致。与PSK理论强调的TA系统在质粒分离后发挥作用不同,研究结果证实TA系统可直接参与质粒的复制过程,是质粒上TA系统的新功能。对IMG数据库的TA系统进行比对研究,这一类TA系统的丰度明显高于ParDE系统,并且参与PrpA抗毒素调控质粒复制的结构域在临床耐药菌的质粒上广泛存在。结合本文的研究我们可以推测,细菌和古菌中广泛分布的TA系统通过多种途径发挥多样的生物学功能。
研究员团队的尼松伟博士和李百元博士为论文共同第一作者,王晓雪研究员与王鹏霞副研究员为论文共同通讯作者。本研究工作得到国家杰出青年科学基金、基金委水圈微生物重大研究计划重点项目、面上项目、国家重点研发计划以及中科院青年创新促进会等项目的共同资助。
相关论文链接:https://www.pnas.org/content/118/4/e2011577118
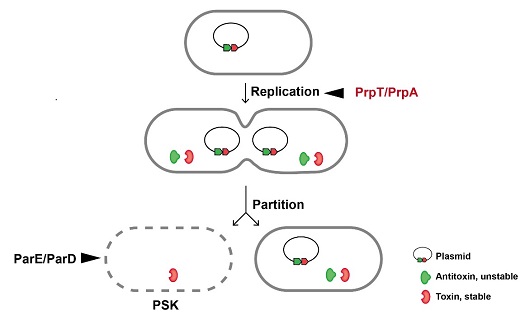
PrpT/PrpA调控质粒的复制
附件下载:
 粤公网安备44011502001245号
粤公网安备44011502001245号